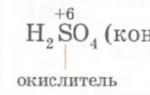Хром как тугоплавкий, но очень полезный в строительстве металл. Хром — общая характеристика элемента, химические свойства хрома и его соединений
Открытие хрома относится к периоду бурного развития химико-аналитических исследований солей и минералов. В России химики проявляли особый интерес к анализу минералов, найденных в Сибири и почти неизвестных в Западной Европе. Одним из таких минералов была сибирская красная свинцовая руда (крокоит), описанная еще Ломоносовым. Минерал исследовался, но ничего, кроме окислов свинца, железа и алюминия в нем не было найдено. Однако в 1797 году Вокелен, прокипятив тонко измельченный образец минерала с поташом и осадив карбонат свинца, получил раствор, окрашенный в оранжево – красный цвет. Из этого раствора он выкристаллизовал рубиново-красную соль, из которой выделили окисел и свободный металл, отличный от всех известных металлов. Вокелен назвал его Хром (Chrome ) от греческого слова - окраска, цвет; правда здесь имелось в виду свойство не металла, а его ярко окрашенных солей .
Нахождение в природе.
Важнейшей рудой хрома, имеющей практическое значение, является хромит, приблизительный состав которого отвечает формуле FeCrO 4.
Он встречается в Малой Азии, на Урале, в Северной Америке, на юге Африки. Техническое значение имеет также вышеназванный минерал крокоит – PbCrO 4 . В природе встречаются также оксид хрома (3) и некоторые другие его соединения. В земной коре содержание хрома в пересчете на металл составляет 0,03%. Хром обнаружен на Солнце, звездах, метеоритах.
Физические свойства .
Хром – белый, твердый и хрупкий металл, исключительно химически стойкий к воздействию кислот и щелочей. На воздухе он окисляется, имеет на поверхности тонкую прозрачную пленку оксида. Хром имеет плотность 7,1 г/см 3 , его температура плавления составляет +1875 0 С.
Получение.
При сильном нагреве хромистого железняка с углем происходит восстановление хрома и железа:
FeO * Cr 2 O 3 + 4C = 2Cr + Fe + 4CO
В результате этой реакции образуется сплав хрома с железом, отличающийся высокой прочностью. Для получения чистого хрома, его восстанавливают из оксида хрома(3) алюминием:
Cr 2 O 3 + 2Al = Al 2 O 3 + 2Cr
В данном процессе обычно используют два оксида – Cr 2 O 3 и CrO 3
Благодаря тонкой защитной пленке оксида, покрывающей поверхность хрома, он весьма устойчив к воздействию агрессивных кислот и щелочей. Хром не реагирует с концентрированными азотной и серной кислотами, а также с фосфорной кислотой. Со щелочами хром вступает во взаимодействие при t = 600-700 о C. Однако хром взаимодействует с разбавленными серной и соляной кислотами, вытесняя водород:
2Cr + 3H 2 SO 4 = Cr 2 (SO 4) 3 + 3H 2
2Cr + 6HCl = 2CrCl 3 + 3H 2
При высокой температуре хром горит в кислороде, образуя оксид(III).
Раскаленный хром реагирует с парами воды:
2Cr + 3H 2 O = Cr 2 O 3 + 3H 2
Хром при высокой температуре реагирует также с галогенами, галоген - водородами, серой, азотом, фосфором, углем, кремнием, бором, например:
Cr + 2HF = CrF 2 + H 2
2Cr + N2 = 2CrN
2Cr + 3S = Cr 2 S 3
Cr + Si = CrSi
Вышеуказанные физические и химические свойства хрома нашли свое применение в различных областях науки и техники. Так, например, хром и его сплавы используются для получения высокопрочных, коррозионно-стойких покрытий в машиностроении. Сплавы в виде феррохрома используются в качестве металлорежущих инструментов. Хромированные сплавы нашли применение в медицинской технике, при изготовлении химического технологического оборудования.

Положение хрома в периодической системе химических элементов:
Хром возглавляет побочную подгруппу VI группы периодической системы элементов. Его электронная формула следующая:
24 Cr IS 2 2S 2 2P 6 3S 2 3P 6 3d 5 4S 1
В заполнении орбиталей электронами у атома хрома нарушается закономерность, согласно которой сначала должна была бы заполнятся 4S – орбиталь до состояния 4S 2 . Однако, вследствие того, что 3d – орбиталь занимает в атоме хрома более выгодное энергетическое положение, происходит ее заполнение до значения 4d 5 . Такое явление наблюдается у атомов некоторых других элементов побочных подгрупп. Хром может проявлять степени окисления от +1 до +6. Наиболее устойчивыми являются cоединения хрома со степенями окисления +2, +3, +6.
Соединения двухвалентного хрома.
Оксид хрома (II) CrO – пирофорный черный порошок (пирофорность – способность в тонкораздробленном состоянии воспламенятся на воздухе). CrO растворяется в разбавленной соляной кислоте:
CrO + 2HCl = CrCl 2 + H 2 O
На воздухе при нагревании свыше 100 0 С CrO превращается в Cr 2 O 3 .
Соли двухвалентного хрома образуются при растворении металлического хрома в кислотах. Эти реакции проходят в атмосфере малоактивного газа (например H 2), т.к. в присутствии воздуха легко происходит окисление Cr(II) до Cr(III).
Гидроксид хрома получают в виде желтого осадка при действии раствора щелочи на хлорид хрома (II):
CrCl 2 + 2NaOH = Cr(OH) 2 + 2NaCl
Cr(OH) 2 обладает основными свойствами, является восстановителем. Гидратированный ион Cr2+ окрашен в бледно – голубой цвет. Водный раствор CrCl 2 имеет синюю окраску. На воздухе в водных растворах соединения Cr(II) переходят в соединения Cr(III). Особенно это ярко выражается у гидроксида Cr(II):
4Cr(OH) 2 + 2H 2 O + O 2 = 4Cr(OH) 3
Соединения трехвалентного хрома.
Оксид хрома (III) Cr 2 O 3 – тугоплавкий порошок зеленого цвета. По твердости близок к корунду. В лаборатории его можно получить нагреванием дихромата аммония:
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2
Cr 2 O 3 – амфотерный оксид, при сплавлении со щелочами образует хромиты: Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
Гидроксид хрома также является амфотерным соединением:
Cr(OH) 3 + HCl = CrCl 3 + 3H 2 O
Cr(OH) 3 + NaOH = NaCrO 2 + 2H 2 O
Безводный CrCl 3 имеет вид листочков темно-фиолетового цвета, совершенно нерастворим в холодной воде, при кипячении он растворяется очень медленно. Безводный сульфат хрома (III) Cr 2 (SO 4) 3 розового цвета, также плохо растворим в воде. В присутствии восстановителей образует фиолетовый сульфат хрома Cr 2 (SO 4) 3 *18H 2 O. Известны также зеленые гидраты сульфата хрома, содержащие меньшее количество воды. Хромовые квасцы KCr(SO 4) 2 *12H 2 O выкристаллизовываются из растворов, содержащих фиолетовый сульфат хрома и сульфат калия. Раствор хромовых квасцов при нагревании становится зеленым благодаря образованию сульфатов.
Реакции с хромом и его соединениями
Почти все соединения хрома и их растворы интенсивно окрашены. Имея бесцветный раствор или белый осадок, мы можем с большой долей вероятности сделать вывод об отсутствии хрома.
- Сильно нагреем в пламени горелки на фарфоровой чашке такое количество бихромата калия, которое поместится на кончике ножа. Соль не выделит кристаллизационной воды, а расплавится при температуре около 400 0 С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде (она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K 2 CrO 4 и зеленый Cr 2 O 3 .
- Растворим 3г порошкообразного бихромата калия в 50мл воды. К одной части добавим немного карбоната калия. Он растворится с выделением CO 2 , а окраска раствора станет светло – желтой. Из бихромата калия образуется хромат. Если теперь по порциям добавить 50% раствор серной кислоты, то снова появится красно – желтая окраска бихромата.
- Нальем в пробирку 5мл. раствора бихромата калия, прокипятим с 3мл концентрированной соляной кислоты под тягой. Из раствора выделяется желто-зеленый ядовитый газообразный хлор, потому, что хромат окислит HCl до Cl 2 и H 2 O. Сам хромат превратится в зеленый хлорид трехвалентного хрома. Его можно выделить выпариванием раствора, а потом, сплавив с содой и селитрой, перевести в хромат.
- При добавлении раствора нитрата свинца выпадает желтый хромат свинца; при взаимодействии с раствором нитрата серебра образуется красно – коричневый осадок хромата серебра.
- Добавим пероксид водорода к раствору бихромата калия и подкислим раствор серной кислотой. Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% - ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
Аналитические реакции на ионы хрома.
- К 3-4 каплям раствора хлорида хрома CrCl 3 прибавьте 2М раствор NaOH до растворения первоначально выпавшего осадка. Обратите внимание на цвет образовавшегося хромита натрия. Нагрейте полученный раствор на водяно бане. Что при этом происходит?
- К 2-3 каплям р-ра CrCl 3 прибавьте равный объем 8М раствора NaOH и 3-4 капли 3% р-ра H 2 O 2 . Нагрейте реакционную смесь на водяной бане. Что при этом происходит? Какой осадок образуется, если полученный окрашеный раствор нейтрализовать, добавить к нему CH 3 COOH, а затем Pb(NO 3) 2 ?
- Налейте в пробирку по 4-5 капель растворов сульфата хрома Cr 2 (SO 4) 3 , IMH 2 SO 4 и KMnO 4 . Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано?
- К 3-4 каплям подкисленного азотной кислотой раствора K 2 Cr 2 O 7 прибавьте 2-3 капли раствора H 2 O 2 и перемешайте. Появляющиеся синее окрашивание раствора обусловлено возникновением надхромовой кислоты H 2 CrO 6:
Cr 2 O 7 2- + 4H 2 O 2 + 2H + = 2H 2 CrO 6 + 3H 2 O
Обратите внимание на на быстрое разложение H 2 CrO 6:
2H 2 CrO 6 + 8H+ = 2Cr 3+ + 3O 2 + 6H 2 O
синий цвет зеленый цвет
Надхромовая кислота значительно более устойчива в органических растворителях.
- К 3-4 каплям подкисленного азотной кислотой раствора K 2 Cr 2 O 7 прибавьте 5 капель изоамилового спирта, 2-3 капли раствора H 2 O 2 и взболтайте реакционную смесь. Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость H 2 CrO 6 в органической и водных фазах.
- При взаимодействии CrO 4 2- и ионами Ba 2+ выпадает желтый осадок хромата бария BaCrO 4 .
- Нитрат серебра образует с ионами CrO 4 2- осадок хромата серебра кирпично-красного цвета.
- Возьмите три пробирки. В одну из них поместите 5- 6 капель раствора K 2 Cr 2 O 7 , во вторую – такой же объем раствора K 2 CrO 4 , а в третью – по три капли обоих растворов. Затем добавте в каждую пробирку по три капли раствора иодида калия. Объясните полученный результат. Подкислите раствор во второй пробирке. Что при этом происходит? Почему?
Занимательные опыты с соединениями хрома
- Смесь CuSO 4 и K 2 Cr 2 O 7 при добавлении щелочи становится зеленой, а в присутствии кислоты становится желтой. Нагревая 2мг глицерина с небольшим количеством (NH 4) 2 Cr 2 O 7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
- Поместить в центр консервной банки с термитом «рубиновую смесь» - тщательно растертый и помещенный в алюминиевую фольгу Al 2 O 3 (4,75г) с добавкой Cr 2 O 3 (0,25г). Чтобы банка подольше не остывала, необходимо закопать под верхний обрез в песок, а после поджигания термита и начала реакции, накрыть ее железным листом и засыпать песком. Банку выкопать через сутки. В итоге образуется красно – рубиновый порошок.
- 10г бихромата калия растирают с 5г нитрата натрия или калия и 10г сахара. Смесь увлажняют и смешивают с коллодием. Если порошок спрессовать в стеклянной трубке, а затем вытолкнуть палочку и поджечь ее с торца, то начнет выползать «змея», сначала черная, а после охлаждения - зеленая. Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз.
- Если смешать растворы сульфата меди и дихромата калия и добавить немного раствора аммиака, то выпадет аморфный коричневый осадок состава 4СuCrO 4 * 3NH 3 * 5H 2 O, который растворяется в соляной кислоте с образованием желтого раствора, а в избытке аммиака получается зеленый раствор. Если далее к этому раствору добавить спирт, то выпадет зеленый осадок, который после фильтрации становится синим, а после высушивания – сине-фиолетовым с красными блестками, хорошо видимыми при сильном освещении.
- Оставшийся после опытов «вулкан» или «фараоновы змеи» оксид хрома можно регенерировать. Для этого надо сплавить 8г Cr 2 O 3 и 2г Na 2 CO 3 и 2,5г KNO 3 и обработать остывший сплав кипятком. Получается растворимый хромат, который можно превратить и в другие соединения Cr(II) и Cr(VI), в том числе и исходный дихромат аммония.
Примеры окислительно – восстановительных переходов с участием хрома и его соединений
1. Cr 2 O 7 2- -- Cr 2 O 3 -- CrO 2 - -- CrO 4 2- -- Cr 2 O 7 2-
a) (NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O б) Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
б) Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
в) 2NaCrO 2 + 3Br 2 + 8NaOH = 6NaBr +2Na 2 CrO 4 + 4H 2 O
г) 2Na 2 CrO 4 + 2HCl = Na 2 Cr 2 O 7 + 2NaCl + H 2 O
2. Cr(OH) 2 -- Cr(OH) 3 -- CrCl 3 -- Cr 2 O 7 2- -- CrO 4 2-
а) 2Cr(OH) 2 + 1/2O 2 + H 2 O = 2Cr(OH) 3
б) Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O
в) 2CrCl 3 + 2KMnO 4 + 3H 2 O = K 2 Cr 2 O 7 + 2Mn(OH) 2 + 6HCl
г) K 2 Cr 2 O 7 + 2KOH = 2K 2 CrO 4 + H 2 O
3. CrO -- Cr(OH) 2 -- Cr(OH) 3 -- Cr(NO 3) 3 -- Cr 2 O 3 -- CrO - 2
Cr 2+
а) CrO + 2HCl = CrCl 2 + H 2 O
б) CrO + H 2 O = Cr(OH) 2
в) Cr(OH) 2 + 1/2O 2 + H 2 O = 2Cr(OH) 3
г) Cr(OH) 3 + 3HNO 3 = Cr(NO 3) 3 + 3H 2 O
д) 4Сr(NO 3) 3 = 2Cr 2 O 3 + 12NO 2 + O 2
е) Cr 2 O 3 + 2 NaOH = 2NaCrO 2 + H 2 O
Элемент хром в роли художника
Химики довольно часто обращались к проблеме создания искусственных пигментов для живописи. В XVIII-XIXвв была разработана технология получения многих живописных материалов. Луи Никола Воклен в 1797г., обнаруживший в сибирской красной руде ранее неизвестный элемент хром, приготовил новую, замечательно устойчивую краску – хромовую зелень. Хромофором ее является водный оксид хрома (III). Под названием « изумрудная зеленая» ее начали выпускать в 1837 году. Позже Л.Вокелен предложил несколько новых красок: баритовую, цинковую и хромовые желтые. Со временем они были вытеснены более стойкими желтыми, оранжевыми пигментами на основе кадмия.
Зеленая хромовая – самая прочная и светостойкая краска, не поддающаяся воздействию атмосферных газов. Растертая на масле хромовая зелень обладает большой кроющей силой и способна к быстрому высыханию, поэтому с XIX в. ее широко применяют в живописи. Огромное значение она имеет в росписи фарфора. Дело в том, что фарфоровые изделия могут декорироваться как подглазурной, так и надглазурной росписью. В первом случае краски наносят на поверхность лишь слегка обожженного изделия, которое затем покрывают слоем глазури. Далее следует основной, высокотемпературный обжиг: для спекания фарфоровой массы и оплавления глазури изделия нагревают до 1350 – 1450 0 С. Столь высокую температуру без химических изменений выдерживают очень немногие краски, а в старину таких вообще было только две – кобальтовая и хромовая. Черный оксид кобальта, нанесенный на поверхность фарфорового изделия, при обжиге сплавляется с глазурью, химически взаимодействуя с ней. В результате образуются ярко-синие силикаты кобальта. Такую декарированную кобальтом синюю фарфоровую посуду все хорошо знают. Оксид хрома (III) не взаимодействует химически с компонентами глазури и просто залегает между фарфоровыми черепками и прозрачной глазурью «глухим» слоем.
Помимо хромовой зелени художники применяют краски, полученные из волконскоита. Этот минерал из группы монтмориллонитов (глинистый минерал подкласса сложных силикатов Na(Mo,Al), Si 4 O 10 (OH) 2 был обнаружен в 1830г. русским минералогом Кеммерером и назван в честь М.Н Волконской – дочери героя битвы при Бородино генерала Н.Н. Раевского, жены декабриста С.Г.Волконского. Волконскоит представляет собой глину, содержащую до 24% оксида хрома, а так же оксиды аллюминея и железа (III). Непостоянство состава минерала, встечающегося на Урале, в Пермской и Кировской областях, обусловливает его разнообразную окраску – от цвета зимней потемневшей пихты до ярко-зеленого цвета болотной лягушки.
Пабло Пикассо обращался к геологам нашей страны с просьбой изучить запасы волконскоита, дающего краску неповторимо свежего тона. В настоящее время разработан способ получения искусственного волконскоита. Интересно отметить, что по данным современных исследований, русские иконописцы использовали краски из этого материала еще в средние века, задолго до его «официального» открытия. Известной популярностью пользовалась у художников и зелень Гинье (создана в 1837г.), хромоформ которой является гидрат окиси хрома Cr 2 O 3 * (2-3) H 2 O, где часть воды химически связана, а часть адсорбирована. Этот пигмент придает краске изумрудный оттенок.
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Хром
ХРОМ -а; м. [от греч. chrōma - цвет, краска]
1. Химический элемент (Сr), твёрдый металл серо-стального цвета (используется при изготовлении твёрдых сплавов и для покрытия металлических изделий).
2. Мягкая тонкая кожа, выдубленная солями этого металла. Сапоги из хрома.
3. Род жёлтой краски, получаемой из хроматов.
◁ Хро́мовый (см.).
хром(лат. Chromium), химический элемент VI группы периодической системы. Назван от греч. chrōma - цвет, краска (из-за яркой окраски соединений). Голубовато-серебристый металл; плотность 7,19 г/см 3 , t пл 1890°C. На воздухе не окисляется. Главные минералы - хромшпинелиды. Хром - обязательный компонент нержавеющих, кислотоупорных, жаростойких сталей и большого числа других сплавов (нихромы, хромали, стеллит). Применяется для хромирования. Соединения хрома - окислители, неорганические пигменты, дубители.
ХРОМХРОМ (лат. chromium, от греческого хрома - цвет, окраска, для соединений хрома характерна широкая цветовая палитра), Cr (читается «хром»), химический элемент с атомным номером 24, атомная масса 51,9961. Расположен в группе VIB в 4 периоде периодической системы элементов.
Природный хром состоит из смеси четырех стабильных нуклидов: 50 Cr (содержание в смеси 4,35%), 52 Cr (83,79%), 53 Cr (9,50%) и 54 Cr (2,36%). Конфигурация двух внешних электронных слоев 3s
2
р
6
d
5
4s
1
.
Степени окисления от 0 до +6 , наиболее характерны +3 (самая устойчивая) и +6 (валентности III и VI).
Радиус нейтрального атома 0,127 нм, радиус ионов (координационное число 6): Cr 2+ 0,073 нм, Cr 3+ 0,0615 нм, Cr 4+ 0,055 нм, Cr 5+ 0,049 нм и Cr 6+ 0,044 нм. Энергии последовательной ионизации 6,766, 16,49, 30,96, 49,1, 69,3 и 90,6 эВ. Сродство к электрону 1,6 эВ. Электроотрицательность по Полингу (см.
ПОЛИНГ Лайнус)
1,66.
История открытия
В 1766 в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO 4 . Современное название - крокоит. В 1797 французский химик Л. Н. Воклен (см.
ВОКЛЕН Луи Никола)
выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Нахождение в природе
Содержание в земной коре 0,035 % по массе. В морской воде содержание хрома 2·10 -5 мг/л. В свободном виде хром практически не встречается. Входит в состав более 40 различных минералов (хромит FeCr 2 O 4 , волконскоит, уваровит, вокеленит и др.). Некоторые метеориты содержат сульфидные соединения хрома.
Получение
Промышленным сырьем при производстве хрома и сплавов на его основе служит хромит. Восстановительной плвкой хромита с коксом (восстановителем), железной рудой и другими компонентами получают феррохром с содержанием хрома до 80% (по массе).
Для получения чистого металлического хрома хромит с содой и известняком обжигают в печах:
2Cr 2 O 3 + 2Na 2 CO 3 + 3O 2 = 4Na 2 CrO 4 + 4CO 2
Образующийся хромат натрия Na 2 CrO 4 выщелачивают водой, раствор фильтруют, упаривают и обрабатывают кислотой. При этом хромат Na 2 CrO 4 переходит в дихромат Na 2 Cr 2 O 7:
2Na 2 CrO 4 + H 2 SO 4 = Na 2 Cr 2 O 7 + Na 2 SO 4 + H 2 O
Полученный дихромат восстанавливают серой:
Na 2 Cr 2 O 7 + 3S = Na 2 S + Cr 2 O 3 + 2SO 2
,
Образующийся чистый оксид хрома(III) Cr 2 O 3 подвергают алюминотермии:
Cr 2 O 3 + 2Al = Al 2 O 3 + 2Cr.
Также используют кремний:
2Cr 2 O 3 + 3Si = 3SiO 2 + 4Cr
Для получения хрома высокой чистоты, технический хром электрохимически очищают от примесей.
Физические и химические свойства
В свободном виде - голубовато-белый металл с кубической объемно-центрированной решеткой, а
= 0,28845 нм. При температуре 39°C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля). Температура плавления 1890°C, температура кипения 2680°C. Плотность 7,19 кг/дм 3 .
Устойчив на воздухе. При 300°C сгорает с образованием зеленого оксида хрома (III) Cr 2 O 3 , обладающего амфотерными свойствами. Сплавляя Cr 2 O 3 со щелочами получают хромиты:
Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
Непрокаленный оксид хрома (III) легко растворяется в щелочных растворах и в кислотах:
Cr 2 O 3 + 6НСl = 2CrСl 3 + 3Н 2 О
При термическом разложении карбонила хрома Cr(OH) 6 получают красный основной оксид хрома(II) CrO. Коричневый или желтый гидроксид Cr(OН) 2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома(II).
При осторожном разложении оксида хрома(VI) CrO 3 в гидротермальных условиях получают диоксид хрома(IV) CrO 2 , который является ферромагнетиком и обладает металлической проводимостью.
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO 3 . Типично кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовая H 2 CrO 4 , дихромовая H 2 Cr 2 O 7 и другие.
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF 2 , CrCl 2 , CrBr 2 и СrI 2 и тригалогениды CrF 3 , CrCl 3 , CrBr 3 и СrI 3 . Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl 3 и трибромид CrBr 3 хрома нелетучи.
Среди тетрагалогенидов хрома устойчив CrF 4 , тетрахлорид хрома CrCl 4 существует только в парах. Известен гексафторид хрома CrF 6 .
Получены и охарактеризованы оксигалогениды хрома CrO 2 F 2 и CrO 2 Cl 2 .
Синтезированы соединения хрома с бором (бориды Cr 2 B, CrB, Cr 3 B 4 , CrB 2 , CrB 4 и Cr 5 B 3), с углеродом (карбиды Cr 23 C 6 , Cr 7 C 3 и Cr 3 C 2), c кремнием (силициды Cr 3 Si, Cr 5 Si 3 и CrSi) и азотом (нитриды CrN и Cr 2 N).
В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион 3- .
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na 3 + 3H 2 O 2 = 2Na 2 CrO 4 + 2NaOH + 8H 2 O
Cr (VI) отвечает ряд существующих только в водных растворах кислот: хромовая H 2 CrO 4 , дихромовая H 2 Cr 2 O 7 , трихромовая H 3 Cr 3 O 10 и другие, которые образуют соли - хроматы, дихроматы, трихроматы и т. д.
В зависимости от кислотности среды анионы этих кислот легко превращаются друг в друга. Например, при подкислении желтого раствора хромата калия K 2 CrO 4 образуется оранжевый дихромат калия K 2 Cr 2 O 7:
2K 2 CrO 4 + 2НСl = K 2 Cr 2 O 7 + 2КСl + Н 2 О
Но если к оранжевому раствору K 2 Cr 2 O 7 прилить раствор щелочи, как окраска вновь переходит в желтую т. к. снова образуется хромат калия K 2 CrO 4:
K 2 Cr 2 O 7 + 2КОН = 2K 2 CrO 4 + Н 2 О
При добавлении к желтому раствору, содержащему хромат-ионы, раствора соли бария выпадает желтый осадок хромата бария BаCrO 4:
Bа 2+ + CrO 4 2- = BаCrO 4
Соединения хрома(III)- сильные окислители, например:
K 2 Cr 2 O 7 + 14 НСl = 2CrCl 3 + 2KCl + 3Cl 2 + 7H 2 O
Применение
Использование хрома основано на его жаропрочности, твердости и устойчивости к коррозии. Применяют для получения сплавов: нержавеющей стали, нихрома и др. Большое количество хрома идет на декоративные коррозионно-стойкие покрытия. Соединения хрома - огнеупорные материалы. Оксид хрома (III) - пигмент зеленой краски, также входит в состав абразивных материалов (паст ГОИ). Изменение окраски при восстановлении соединений хрома(VI) применяют для проведения экспресс-анализа на содержание алкоголя в выдыхаемом воздухе.
Катион Cr 3+ входит в состав хромкалиевых KCr(SO 4) 2 ·12H 2 O квасцов, использующихся при выделке кожи.
Физиологическое действие
Хром - один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хромма в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Металлический хром практически нетоксичен, но металлическая пыль хрома раздражает ткани легких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м 3 .
Энциклопедический словарь . 2009 .
Синонимы :Смотреть что такое "хром" в других словарях:
хром - хром, а … Русский орфографический словарь
хром - хром/ … Морфемно-орфографический словарь
- (от греч. chroma цвет, краска). Металл сероватого цвета, добываемый из хромовой руды. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ХРОМ металл сероватого цвета; в чистом виде х. не употребляется; соединения же с … Словарь иностранных слов русского языка
ХРОМ - см. ХРОМ (Сг). Соединения хрома встречаются в сточных водах многих промышленных предприятий, производящих хромовые соли, ацетилен, дубильные вещества, анилин, линолеум, бумагу, краски, пестициды, пластмассы и др. В воде встречаются трехвалентные… … Болезни рыб: Справочник
ХРОМ, а, муж. 1. Химический элемент, твёрдый светло серый блестящий металл. 2. Род жёлтой краски (спец.). | прил. хромистый, ая, ое (к 1 знач.) и хромовый, ая, ое. Хромистая сталь. Хромовая руда. II. ХРОМ, а, муж. Сорт мягкой тонкой кожи. | прил … Толковый словарь Ожегова
хром - а, м. chrome m. <новолат. chromium <лат. chroma <гр. краска. 1. Химический элемент твердый серебристый металл, употребляемый при изготовлении твердых сплаво и для покрытия металлических изделий. БАС 1. Металл, открытый Вокеленом,… … Исторический словарь галлицизмов русского языка
ХРОМ - ХРОМ, Chromium (от греч. chroma краска), I симв. Сг, хим. элемент с ат. весом 52,01 (изо! топы 50, 52, 53, 54); порядковое число 24, за! нимает место в четной подгруппе VІ группы j таблицы Менделеева. Соединения X. часто i встречаются в природе … Большая медицинская энциклопедия
- (лат. Chromium) Cr, химический элемент VI группы Периодической системы Менделеева, атомный номер 24, атомная масса 51,9961. Название от греч. chroma цвет, краска (из за яркой окраски Соединения). Голубовато серебристый металл; плотность 7,19… … Большой Энциклопедический словарь
ХРОМ 1, а, м. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ХРОМ 2, а, м. Сорт мягкой тонкой кожи. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Хром - химический элемент с атомным номером 24. Это твердый, блестящий, серо-стального цвета металл, который хорошо полируется и не тускнеет. Используется в сплавах, таких как нержавеющая сталь, и в качестве покрытия. Организму человека требуются небольшие количества трехвалентного хрома для метаболизма сахара, но Cr (VI) очень токсичен.
Различные соединения хрома, такие как окись хрома (III) и хромат свинца, ярко окрашены и используются в красках и пигментах. Красный цвет рубина обусловлен наличием этого химического элемента. Некоторые вещества, особенно и натрия, являются окислителями, используемыми для окисления органических соединений и (вместе с серной кислотой) для очистки лабораторной посуды. Кроме того, окись хрома (VI) применяется в производстве магнитной ленты.
Открытие и этимология
История открытия химического элемента хром такова. В 1761 году Иоганн Готлоб Леман нашел в Уральских горах оранжево-красный минерал и назвал его «сибирским красным свинцом». Хотя он ошибочно был идентифицирован как соединение свинца с селеном и железом, материал на самом деле являлся хроматом свинца с химической формулой PbCrO 4 . Сегодня он известен как минерал кроконт.
В 1770 году Петр Симон Паллас посетил то место, где Леман нашел красный свинцовый минерал, который имел очень полезные свойства пигмента в красках. Использование сибирского красного свинца в качестве краски получило быстрое развитие. Кроме того, ярко-желтый цвет из кроконта стал модным.
В 1797 году Николя-Луи Воклен получил образцы красной Путем смешивания кроконта с соляной кислотой он получил оксид CrO 3 . Хром как химический элемент был выделен в 1798 году. Воклен получил его при нагревании окисла с древесным углем. Он также смог обнаружить следы хрома в драгоценных камнях, таких как рубин и изумруд.
В 1800-х годах Cr в основном применялся в составе красок и кожевенных солей. Сегодня 85% металла используется в сплавах. Остальная часть применяется в химической промышленности, производстве огнеупорных материалов и литейной промышленности.
Произношение химического элемента хром соответствует греческому χρῶμα, что означает «цвет», из-за множества цветных соединений, которые из него можно получить.

Добыча и производство
Элемент производят из хромита (FeCr 2 O 4). Примерно половина этой руды в мире добывается в Южной Африке. Кроме того, Казахстан, Индия и Турция являются его крупными производителями. Разведанных месторождений хромита достаточно, но географически они сконцентрированы в Казахстане и на юге Африки.
Залежи самородного металлического хрома встречаются редко, но они есть. Например, его добывают на шахте «Удачная» в России. Она является богатой алмазами, и восстановительная среда помогла образоваться чистому хрому и алмазам.
Для промышленного производства металла хромитовые руды обрабатывают расплавленной щелочью (едким натром, NaOH). При этом образуется хромат натрия (Na 2 CrO 4), который восстанавливается углеродом до оксида Сг 2 O 3 . Металл получают при нагревании окисла в присутствии алюминия или кремния.
В 2000 году было добыто около 15 млн т хромитовой руды, которая была переработана в 4 млн т феррохрома, на 70% состоящего из сплава хрома с железом, приблизительная рыночная стоимость которых составила 2,5 млрд долларов США.

Основные характеристики
Характеристика химического элемента хрома обусловлена тем, что он является переходным металлом четвертого периода таблицы Менделеева и расположен между ванадием и марганцем. Входит в VI группу. Плавится при температуре 1907 °С. В присутствии кислорода хром быстро образует тонкий слой оксида, который защищает металл от дальнейшего взаимодействия с кислородом.
Как переходный элемент, он реагирует с веществами в различных соотношениях. Таким образом он образует соединения, в которых имеет различные степени окисления. Хром - химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Какого цвета хром? Химический элемент придает рубиновый оттенок. Сг 2 O 3 , используемый для также применяется в качестве пигмента под названием «хромовая зелень». Его соли окрашивают стекло в изумрудно-зеленый цвет. Хром - химический элемент, присутствие которого делает рубин красным. Поэтому он используется в производстве синтетических рубинов.

Изотопы
Изотопы хрома обладают атомным весом от 43 до 67. Обычно данный химический элемент состоит из трех стабильных форм: 52 Cr, 53 Cr и 54 Cr. Из них наиболее распространен 52 Cr (83,8% всего природного хрома). Кроме того, описаны 19 радиоизотопов, из которых наиболее стабильным является 50 Cr с периодом полураспада, превышающим 1,8x10 17 лет. У 51 Cr период полураспада - 27,7 дней, а у всех остальных радиоактивных изотопов он не превышает 24 ч, причем у большинства из них он длится менее одной минуты. Элемент также имеет два метасостояния.
Изотопы хрома в земной коре, как правило, сопутствуют изотопам марганца, что находит применение в геологии. 53 Cr образуется при радиоактивном распаде 53 Mn. Соотношение изотопов Mn/Cr подкрепляет другие сведения о ранней истории Солнечной системы. Изменения в соотношениях 53 Cr/ 52 Cr и Mn/Cr из разных метеоритов доказывает то, что новых атомные ядра были созданы непосредственно перед формированием Солнечной системы.

Химический элемент хром: свойства, формула соединений
Оксид хрома (III) Сг 2 O 3 , также известный как полуторная окись, является одним из четырех окислов этого химического элемента. Его получают из хромита. Соединение зеленого цвета обычно называют «хромовой зеленью», когда используют в качестве пигмента для живописи по эмали и стеклу. Оксид может растворяться в кислотах, образуя соли, а в расплавленной щелочи - хромиты.
Бихромат калия
K 2 Cr 2 O 7 является мощным окислителем и ему отдается предпочтение в качестве средства для очистки лабораторной посуды от органики. Для этого используется его насыщенный раствор в Иногда, однако, его заменяют бихроматом натрия, исходя из более высокой растворимости последнего. Кроме того, он может регулировать процесс окисления органических соединений, преобразуя первичный спирт в альдегид, а затем в углекислоту.
Бихромат калия способен вызвать хромовый дерматит. Хром, вероятно, является причиной сенсибилизации, ведущей к развитию дерматита, особенно рук и предплечий, который носит хронический характер и трудно излечим. Как и другие соединения Cr (VI), бихромат калия канцерогенен. С ним нужно обращаться в перчатках и соответствующими средствами защиты.

Хромовая кислота
Соединение обладает гипотетической структурой H 2 CrO 4 . Ни хромовая, ни дихромовая кислоты не встречаются в природе, но их анионы находят в различных веществах. «Хромовая кислота», которую можно встретить в продаже, на самом деле является ее кислотным ангидридом - триоксидом CrO 3 .
Хромат свинца (II)
PbCrO 4 обладает ярко-желтой окраской и практически не растворим в воде. По этой причине он нашел применение в качестве красящего пигмента под названием «желтый крон».
Cr и пятивалентная связь
Хром отличается своей способностью образовывать пятивалентные связи. Соединение создается Cr (I) и углеводородным радикалом. Пятивалентная связь формируется между двумя атомами хрома. Его формула может быть записана как Ar-Cr-Cr-Ar, где Ar представляет собой специфическую ароматическую группу.

Применение
Хром - химический элемент, свойства которого обеспечили ему множество различных вариантов применения, некоторые из которых приведены ниже.
Металлам он придает устойчивость к коррозии и глянцевую поверхность. Поэтому хром входит в состав таких сплавов, как нержавеющая сталь, используемых, например, в столовых приборах. Он также применяется для нанесения хромированного покрытия.
Хром является катализатором различных реакций. Из него делают формы для обжига кирпича. Его солями дубят кожу. Бихромат калия применяют для окисления органических соединений, таких как спирты и альдегиды, а также для очистки лабораторной посуды. Он служит фиксирующим агентом для окрашивания ткани, а также используется в фотографии и фотопечати.
CrO 3 применяется для изготовления магнитных лент (например, для аудиозаписи), которые обладают лучшими характеристиками, чем пленки с оксидом железа.
Роль в биологии
Трехвалентный хром - химический элемент, необходимый для метаболизма сахара в организме человека. Напротив, шестивалентный Cr очень токсичен.
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента - около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
Свойства элемента
Основные физические свойства хрома следующие:
- Атомное число: 24.
- Атомный вес: 51,996.
- Температура плавления: 1890 °C.
- Температура кипения: 2482 °C.
- Степень окисления: +2, +3, +6.
- Конфигурация электронов: 3d 5 4s 1 .
Содержание статьи
ХРОМ – (Chromium) Cr, химический элемент 6(VIb) группы Периодической системы. Атомный номер 24, атомная масса 51,996. Известно 24 изотопа хрома с 42 Cr по 66 Cr. Изотопы 52 Cr, 53 Cr, 54 Cr являются стабильными. Изотопный состав природного хрома: 50 Cr (период полураспада 1,8·10 17 лет) – 4,345%, 52 Cr – 83,489%, 53 Cr – 9,501%, 54 Cr – 2,365%. Основные степени окисления +3 и +6.
В 1761 профессор химии Петербургского университета Иоганн Готтлоб Леман (Johann Gottlob Lehmann) у восточного подножия Уральских гор на Березовском руднике обнаружил замечательный красный минерал, который при измельчении в порошок давал яркую желтую окраску. В 1766 Леман привез образцы минерала в Петербург. Обработав кристаллы соляной кислотой, он получил белый осадок, в котором обнаружил свинец. Леман назвал минерал сибирским красным свинцом (plomb rouge de Sibérie), теперь известно, что это был крокоит (от греческого «krokos» – шафран) – природный хромат свинца PbCrO 4 .
Немецкий путешественник и естествоиспытатель Петер Симон Паллас (Peter Simon Pallas) (1741–1811) возглавил экспедицию Петербургской Академии наук в центральные регионы России и в 1770 побывал на Южном и Среднем Урале, в том числе на Березовском руднике и, подобно Леману, заинтересовался крокоитом. Паллас писал: «Этот удивительный красный свинцовый минерал не встречается более ни в одном месторождении. При растирании в порошок становится желтым, и может быть использован в художественной миниатюре». Несмотря на редкость и трудность доставки крокоита с Березовского рудника в Европу (на это уходило почти два года), использование минерала в качестве красящего вещества было оценено по достоинству. В Лондоне и Париже конца 17 в. все знатные особы ездили на каретах, покрашенных мелко растертым крокоитом, кроме того, лучшие образцы сибирского красного свинца пополняли коллекции многих минералогических кабинетов Европы.
В 1796 образец крокоита попал к профессору химии Парижской минералогической школы Никола Луи Вокелену (Nicolas-Louis Vauquelin) (1763–1829), который проанализировал минерал, но не нашел в нем ничего кроме оксидов свинца, железа и алюминия. Продолжая исследования сибирского красного свинца, Вокелен прокипятил минерал с раствором поташа и после отделения белого осадка карбоната свинца получил желтый раствор неизвестной соли. При обработке его солью свинца образовывался желтый осадок, солью ртути – красный, а при добавлении хлорида олова раствор становился зеленым. Разлагая крокоит минеральными кислотами, он получил раствор «кислоты красного свинца», упаривание которой давало рубиново-красные кристаллы (сейчас понятно, что это был хромовый ангидрид). Прокалив их с углем в графитовом тигле, обнаружил после реакции множество сросшихся серых игольчатых кристаллов неизвестного до того времени металла. Вокелен констатировал высокую тугоплавкость металла и его устойчивость по отношению к кислотам.
Вокелен назвал новый элемент хромом (от греческого crwma – цвет, окраска) ввиду множества образуемых им разноцветных соединений. На основании своих исследований Вокелен впервые констатировал, что изумрудная окраска некоторых драгоценных камней объясняется примесью в них соединений хрома. Например, природный смарагд представляет собой окрашенный в глубокий зеленый цвет берилл, в котором алюминий частично замещен хромом.
Скорее всего, Вокеленом был получен не чистый металл, а его карбиды, о чем свидетельствует игольчатая форма полученных кристаллов, но Парижская Академия наук тем не менее зарегистрировала открытие нового элемента, и сейчас Вокелен справедливо считается первооткрывателем элемента № 24.
Юрий Крутяков
Описание
Хром, как химический элемент представляет собой твердое металлическое вещество голубовато-белого цвета (см. фото). Он не окисляется при контакте с воздухом. Иногда его относят к черным металлам. Название свое он заслужил благодаря разнообразным комбинациям цвета своих соединений, и происходит оно от греческого слова chroma – цвет. Интересный факт, что слог «хром» применяется во многих сферах жизни. Например, слово «хромосома» (с греч.) – «тело, которое окрашивается».
Открытие этого элемента приходится на 1797 год и принадлежит Л.Н. Воклену. Он обнаружил его в минерале крокоите.
Большой природный запас хрома находится в земной коре, что не скажешь о морской воде. Страны, которые обладают этими запасами - это ЮАР, Зимбабве, США, Турция, Мадагаскар и другие. Биогенные соединения этого микроэлемента входят в состав тканей растений и животных, причем большее содержание приходится на животных.
Важное влияние хрома на организм человека было определено после проведения опыта на крысах в конце 1950-х годов. Двое ученых, Щварц и Мерц, в качестве эксперимента кормили крыс пищей, скудной на хром, что привело к появлению у животных непереносимости сахара, но при добавлении его в рацион, эти симптомы исчезали.
Действие хрома и его роль в организме
 Хром в организме человека задействован во многих сферах и имеет очень важную роль, однако основная его задача заключается в поддержке нормального баланса сахара в сыворотке крови.
Это происходит за счет усиления процесса обмена углеводов путем облегчения транспортировки глюкозы внутрь клетки. Данное явление носит название глюкотолерантный фактор (ГТФ). Минерал раздражает рецепторы клетки по отношению к инсулину, который легче вступает с ней в взаимодействие, при этом уменьшается его потребность для организма. Поэтому микроэлемент так жизненно важен для диабетиков, особенно со II типом болезни (инсулин-независимым), так как их способность пополнять запасы хрома с пищей очень мала. Даже, если человек не болен диабетом, но у него присутствуют проблемы с обменом веществ, то он автоматически попадает в категорию риска и его состояние расценивается как диабетоподобное.
Хром в организме человека задействован во многих сферах и имеет очень важную роль, однако основная его задача заключается в поддержке нормального баланса сахара в сыворотке крови.
Это происходит за счет усиления процесса обмена углеводов путем облегчения транспортировки глюкозы внутрь клетки. Данное явление носит название глюкотолерантный фактор (ГТФ). Минерал раздражает рецепторы клетки по отношению к инсулину, который легче вступает с ней в взаимодействие, при этом уменьшается его потребность для организма. Поэтому микроэлемент так жизненно важен для диабетиков, особенно со II типом болезни (инсулин-независимым), так как их способность пополнять запасы хрома с пищей очень мала. Даже, если человек не болен диабетом, но у него присутствуют проблемы с обменом веществ, то он автоматически попадает в категорию риска и его состояние расценивается как диабетоподобное.
Выходит, что положительное действие хрома проявляется во всех недугах, связанных со слабым взаимодействием организма с инсулином. Такими болезнями являются гипергликемия (гипогликемия), ожирение, гастриты, колиты, язвы, болезнь Крона, болезнь Миньера, рассеянный склероз, мигрени, эпилепсия, инсульт, гипертония.
Хром участвует в синтезе нуклеиновых кислот и тем самым поддерживает целостность структуры РНК и ДНК, которые несут информацию о генах и отвечают за наследственность.
Если у человека проявляется йододефицит и восполнить его нет возможности - хром может его заменить, что очень важно для нормального функционирования щитовидной железы, которая в свою очередь отвечает за правильный обмен веществ.

Хром снижает риск развития многих сердечнососудистых заболеваний. Как он действует? Макроэлемент принимает участие в метаболизме липидов. Он расщепляет вредный холестерин низкой плотности, который забивает сосуды, тем самым препятствуя нормальной циркуляции крови. При этом повышается содержание холестерина, который выполняет положительные функции в организме.
Повышая степень содержания стероидного гормона, минерал укрепляет кости . В связи с этим полезным свойством ним лечат остеопороз. Хром в сочетании с витамином С участвует в процессе регулирования внутриглазного давления и стимулирует транспортировку глюкозы к кристаллику глаза. Эти свойства позволяют использовать данное химическое вещество в лечебных процессах против глаукомы и катаракты.
Цинк, железо и ванадий оказывают отрицательное воздействие на попадание хрома в тело человека. Для своей транспортировки в крови он образует связь с белковым соединением трансферрином, который, в случае конкуренции хрома с вышеперечисленными элементами, выберет последнего. Поэтому в организме человека с переизбытком железа, всегда присутствует дефицит хрома, что может ухудшить состояние при диабете.
Основная его часть содержится в органах и тканях, а в крови – в десятки раз меньше. Поэтому, если в организме происходит пересыщение глюкозой, то количество макроэлемента в крови резко увеличивается за счет его передислокации из органов-накопителей.
Суточная норма
 Физиологическая потребность в минерале обусловлена возрастом и полом человека. В раннем грудном возрасте эта потребность отсутствует, так как у младенцев он накопился еще до рождения и расходуется до 1 года. Далее, для малышей в возрасте 1-2 лет эта норма составляет 11 мкг в сутки. С 3 до 11 лет - это 15 мкг/сутки. В среднем возрасте (11-14 лет) потребность увеличивается до 25 мкг/сутки, а в подростковом (14-18 лет) - до 35 мкг/сутки. Что же касается взрослого человека, тут уж отметка достигает 50 мкг/сутки.
Физиологическая потребность в минерале обусловлена возрастом и полом человека. В раннем грудном возрасте эта потребность отсутствует, так как у младенцев он накопился еще до рождения и расходуется до 1 года. Далее, для малышей в возрасте 1-2 лет эта норма составляет 11 мкг в сутки. С 3 до 11 лет - это 15 мкг/сутки. В среднем возрасте (11-14 лет) потребность увеличивается до 25 мкг/сутки, а в подростковом (14-18 лет) - до 35 мкг/сутки. Что же касается взрослого человека, тут уж отметка достигает 50 мкг/сутки.
В норме содержание хрома в организме должно быть около 6 мг. Но даже если придерживаться правильного питания, достижение нормы очень затруднительно. Только в органических соединениях идет усваивание микроэлементов, а способствуют этому процессу аминокислоты, которые находятся только в растениях. Поэтому лучшие источники этого минерала находятся в пище, в натуральных продуктах.
Если доза составляет более 200 мг, то он становится токсичен, а 3 г - смертельны.
Недостаток или дефицит хрома
Есть несколько причин возникновения недостатка минерала в организме. Из-за внедрения в почву определенных удобрений она пересыщена щелочными соединениями, что уменьшает содержание элемента в нашем рационе питания. Но даже если поступление этого минерала с продуктами полноценно, усвоение хрома будет затруднено при нарушенном обмене веществ. Также недостаток может возникнуть и по причине тяжелых физических нагрузок, в состоянии беременности, стрессовых состояниях - в случаях, когда минерал активно расходуется и необходимы дополнительные источники для его пополнения.
При нехватке микроэлемента глюкоза усваивается неэффективно, поэтому ее содержание может быть занижено (гипогликемия) или завышено (гипергликемия). Повышается уровень холестерина и сахара в крови. Это приводит к повышенной тяге к сладкому - организм требует углеводов и не только «сладких». Чрезмерное употребление углеводов ведет к еще более значительной потере хрома - замкнутый круг. В конце концов, возникают такие болезни, как избыточный вес (в случае гипогликемии - резкое похудение), сахарный диабет, атеросклероз.
Также при недостатке хрома можно наблюдать такие последствия (симптомы):

- нарушение сна, беспокойные состояния;
- головные боли;
- задержка роста;
- нарушение зрения;
- снижение чувствительности ног и рук;
- нарушается работа нервно-мышечных комплексов;
- снижается репродуктивная функция у мужского пола;
- наблюдается чрезмерная утомляемость.
При дефиците хрома, если нет возможности пополнить его запасы с приемами пищи, необходимо добавлять в свой рацион биодобавки, но перед употреблением нужно провести консультации с доктором о дозах и способах приема.
Избыток хрома - в чем его вред?
В основном переизбыток хрома в органах и тканях происходит из-за отравления на предприятиях, в технологический процесс которых входит наличие хрома и его пыли. Люди, которые работают на вредных производствах и контактируют с этим элементом, болеют раком дыхательных путей в десятки раз чаще, так как хром воздействует на хромосомы и соответственно на структуру клеток. Соединения хрома также присутствуют в шлаках и медной пыли, что проводит к астматическим болезням.

Дополнительная опасность переизбытка микроэлемента может появиться при неправильном приеме биодобавок без рекомендации врача. Если у человека наблюдается дефицит цинка или железа, то вместо них всасывается чрезмерное количество хрома.
Помимо вышеперечисленных недугов, избыто хрома может быть вреден еще и тем, что могут появиться язвы на слизистых оболочках, аллергии, экземы и дерматиты, нервные расстройства.
В каких пищевых источниках содержится?
 Из каких пищевых продуктов можно пополнить запас хрома? Самый ценный продукт в этом случае - это пивные дрожжи, причем можно употреблять и пиво, но в разумных пределах без вреда для здоровья. Также богаты на этот микроэлемент печень, орехи, морепродукты, проросшие зерна пшеницы, арахисовое масло, перловка, ячмень, говядина, яйца, сыр, грибы, хлеб из муки грубого помола. Из овощей выделяют капуста, репчатый лук, редис, бобовые, зеленый горошек, помидоры, кукуруза, ревень, свекла, а из фруктов и ягод - это рябина, яблоки, голубика, виноград, черника, облепиха. Заваривая чайки из лекарственных растений (сушеницы, мелиссы), можно тоже подзарядиться хромом.
Из каких пищевых продуктов можно пополнить запас хрома? Самый ценный продукт в этом случае - это пивные дрожжи, причем можно употреблять и пиво, но в разумных пределах без вреда для здоровья. Также богаты на этот микроэлемент печень, орехи, морепродукты, проросшие зерна пшеницы, арахисовое масло, перловка, ячмень, говядина, яйца, сыр, грибы, хлеб из муки грубого помола. Из овощей выделяют капуста, репчатый лук, редис, бобовые, зеленый горошек, помидоры, кукуруза, ревень, свекла, а из фруктов и ягод - это рябина, яблоки, голубика, виноград, черника, облепиха. Заваривая чайки из лекарственных растений (сушеницы, мелиссы), можно тоже подзарядиться хромом.
Бедны на этот микроэлемент высокоочищенные продукты: сахар, макароны, мука тонкого помола, кукурузные хлопья, молоко, масло, маргарин. Вообще, пища с большим содержанием жиров всегда беднее на микроэлементы, чем пища с пониженным их содержанием. И еще, в продуктах хром сохранится лучше, если приготовлены они были в посуде из нержавеющей стали.
Показания к применению препаратов хрома
Хром (препараты с хромом) назначают как для профилактики, так и для лечения внутренних болезней:
- нарушение обмена веществ: сахарный диабет, ожирение;
- заболевания кишечника;
- болезни печени и сопутствующих ей органов;
- сердечно сосудистая патология;
- воспалительные процессы в мочевыводящих путях и заболевания почек;
- аллергические состояния, сопровождающиеся дисбактериозом;
- различные формы иммунодефицита.
Также хром назначается в соответствии со следующими показаниями:
- для профилактики болезней сердца и онкологических предрасположенностей;
- для защиты от болезни Паркинсона и при депрессии;
- как вспомогательное средство при похудении;
- для укрепления иммунной системы;
- для устранения негативных последствий воздействия окружающей среды;
- при состояниях, сопровождающихся повышенным потреблением хрома (беременность, лактация, период роста и полового созревания, тяжелые физические нагрузки).